cefazolina sódica
USO INTRAVENOSO E INTRAMUSCULAR
USO ADULTO E PEDIÁTRICO
- FORMA FARMACÊUTICA E APRESENTAÇÕES:
Pó para solução injetável
CEZOLIN (cefazolina sódica) 1g: cada frasco-ampola contém cefazolina sódica equivalente a 01 e 50 frascos-ampola.
Composição de Cezolin
Cada frasco-ampola de CEZOLIN (cefazolina sódica) 1 g contém:
Cefazolina sódica................................................................1,048g*
*equivalente a 1g de cefazolina.
PARTE I
Informações ao Paciente de Cezolin
COMO ESTE MEDICAMENTO FUNCIONA?
É um medicamento antibacteriano e pertence a uma classe chamada de cefalosporinas. Em doses adequadas, promove a destruição das bactérias.
QUAIS AS PRINCIPAIS INDICAÇÕES DESTE MEDICAMENTO?
Este medicamento é indicado particularmente para: endocardite bacteriana (infecção nas válvulas do coração); infecção nas juntas; infecção da pele e dos tecidos moles; infecção nos ossos; prevenção de infecção durante cirurgia; infecção urinária; infecção nos pulmões; infecção no sangue.
QUANDO NÃO DEVO USAR ESTE MEDICAMENTO?
Este produto deve ser evitado se você já tiver apresentado reação alérgica a penicilinas, derivados da penicilina, penicilamina ou a outras cefalosporinas.
Condições que exigem avaliação dos riscos e benefícios:
- Diminuição da função dos rins (doses devem ser reduzidas);
- Histórico de doença gastrointestinal, particularmente doenças conhecidas como colite ulcerativa, enterite regional ou colite associada a antibióticos. Nesses casos pode ocorrer uma doença mais grave denominada colite pseudomembranosa;
- História de doença com sangramento. O sangramento pode ser agravado pela diminuição de uma substância que entra no processo de coagulação do sangue (protrombina).
INFORME AO MÉDICO OU CIRURGIÃO-DENTISTA O APARECIMENTO DE REAÇÕES INDESEJÁVEIS.
Mães Amamentando: O produto é excretado no leite em pequenas proporções. Não há contudo, relato de problemas.
Atenção ao utilizar outros medicamentos. Este produto:
- Pode aumentar os riscos de hemorragia com: medicamentos conhecidos como inibidores da agregação plaquetária.
- Pode ter aumentada a sua ação e os efeitos tóxicos com: probenecida.
- Pode aumentar os riscos de toxicidade nos rins com: medicamentos que causam agressão aos rins.
COMO USAR ESTE MEDICAMENTO?
Aspecto físico: pó cristalino branco a branco amarelado.
Este medicamento é de uso injetável, portanto deve ser administrado somente em serviços profissionais autorizados.
Pode ser aplicado por: via intramuscular, nas nádegas (quadrante superior externo), ou via intravenosa (através de injeção lenta, com duração de pelo menos 3 a 5 minutos).
As doses deste medicamento são variáveis, de acordo com a infecção e as condições do paciente. Em geral as doses médias são:
Adultos
Infecção Leve: 250 a 500 mg, a cada 8 horas;
Infecção Moderada a grave: 500 mg a 1 g, a cada 6 ou 8 horas;
Infecção grave com risco de vida: 1 g a 1,5 g, a cada 6 horas;
Infecção urinária (aguda não complicada): 1 g, a cada 12 horas;
Prevenção de infecção durante cirurgias (via intravenosa): 1 g, meia à uma hora antes do início da cirurgia; 500 mg a 1 g durante a cirurgia; após a cirurgia: 500 mg a 1 g, a cada 6 ou 8 horas, até completar 24 horas.
Limite de dose para adultos: 6 g por dia.
Idosos
Podem exigir diminuição das doses se houver diminuição da função dos rins.
Crianças
Endocardite (profilaxia): 25 mg por quilograma de peso corporal, 30 minutos antes do início da cirurgia.
Outras Infecções:
Crianças a partir de 1 mês de idade (infusão intravenosa): 6,25 a 25 mg por quilograma de peso corporal, a cada 6 horas; ou 8,3 a 33,3 mg por quilograma de peso corporal, a cada 8 horas.
Crianças com menos de 1 mês de idade (infusão intravenosa): 20 mg por quilograma de peso corporal, a cada 8 ou 12 horas.
SIGA A ORIENTAÇÃO DE SEU MÉDICO, RESPEITANDO SEMPRE OS HORÁRIOS, AS DOSES E A DURAÇÃO DO TRATAMENTO.
NÃO INTERROMPA O TRATAMENTO SEM O CONHECIMENTO DE SEU MÉDICO.
NÃO USE O MEDICAMENTO COM O PRAZO DE VALIDADE VENCIDO.
ANTES DE USAR OBSERVE O ASPECTO DO MEDICAMENTO.
QUAIS AS EVENTUAIS REAÇÕES QUE ESTE MEDICAMENTO PODE CAUSAR?
- Desenvolvimento de Candidíase oral (Monilíase ou “sapinho” na boca), com o uso prolongado;
- Candidíase vaginal (Monilíase vaginal);
- Dor de cabeça;
- Colite pseudomembranosa (sintomas: dor abdominal grave ou dor e cólicas no estômago, abdômen sensível ao toque, diarréia aquosa grave que pode se transformar em sanguinolenta, febre);
- Diarréia;
- Diminuição da protrombina no sangue;
- Reações raras: anemia, convulsões; perturbação da função dos rins; dor nas juntas; erupção na pele; reações alérgicas; tromboflebite (inflamação das veias).
O QUE FAZER SE ALGUÉM USAR UMA GRANDE QUANTIDADE DESTE MEDICAMENTO DE UMA SÓ VEZ?
Procurar o hospital mais próximo ou um Centro de Controle de Intoxicações da região. Em caso de superdosagem grave, pode ser considerado o uso combinado de hemodiálise (procedimento de “filtração do sangue”), se outras terapias falharem.
ONDE E COMO DEVO GUARDAR ESTE MEDICAMENTO?
CEZOLlN (cefazolina sódica) deve ser armazenado em temperatura ambiente (entre 15° a 30°C) e protegido da luz. CEZOLIN (cefazolina sódica) reconstituído com Água Estéril para Injeção é estável por 12 horas em temperatura ambiente e por 24 horas sob refrigeração (2°a 8°C).
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
PARTE II
Informações ao Profissional da Saúde de Cezolin
INFORMAÇÕES TÉCNICAS:
Caracteristicas Farmacológicas de Cezolin
Descrição: cefazolina sódica é uma cefalosporina semi-sintética para administração parenteral. É o sal sódico do 3-{[(5-metil-1,3,4- tiadiazol-2-il)tiol]meti l}-8-oxo-7-[2-(1 H-tetrazol-1-i l)acetamido]-5- tia-1-azabiciclo[4.2.0]octo-2-eno-2-ácidocarboxílico. O teor de sódio é 48,3 mg por grama de cefazolina sódica.
Farmacologia Humana: após administração intramuscular em voluntários normais, as concentrações séricas médias de cefazolina foram 37 mcg/mL em 1 hora e 3 mcg/mL em 8 horas com uma dose de 500 mg e, 64 mcg/mL em 1 hora e 7 mcg/mL em 8 horas com dose de 1 g.
Após a administração intravenosa de cefazolina em voluntários normais, as concentrações séricas médias apresentaram um pico de aproximadamente 185 mcg/mL e foram de aproximadamente 4 mcg/mL em 8 horas, com uma dose de 1 g. A meia-vida sérica da cefazolina é aproximadamente 1,8 hora após administração l.V. e aproximadamente 2 horas após administração l.M. Em um estudo (usando voluntários normais) com infusões intravenosas constantes, de 3,5 mg/kg durante 1 hora (aproximadamente 250 mg) e 1,5 mg/kg nas 2 horas seguintes (aproximadamente 100 mg), a cefazolina produziu um nível sérico constante de aproximadamente 28 mcg/mL na terceira hora. Estudos com pacientes hospitalizados com infecção indicam que a cefazolina injetável produz níveis séricos médios equivalentes aos observados em voluntários normais.
Em pacientes sem doença obstrutiva biliar, os níveis na bile podem atingir ou exceder até 5 vezes os níveis séricos; porém, em pacientes com doença obstrutiva biliar, os níveis biliares de cefazolina são consideravelmente menores que os níveis séricos (<1,0 mcg/mL).
No líquido sinovial, os níveis de cefazolina são comparáveis aos alcançados no soro cerca de 4 horas após a administração. Estudos no sangue do cordão umbilical demonstram pronta transferência da cefazolina através da placenta. A cefazolina está presente em concentrações muito baixas no leite de mães que estão amamentando. A cefazolina é excretada inalterada na urina. Nas primeiras 6 horas aproximadamente 60% do medicamento são excretados na urina, aumentando para 70% a 80% em 24 horas. A cefazolina atinge concentrações urinárias máximas de aproximadamente 2400 mcg/mL e 4000 mcg/mL após doses intramusculares de 500 mg e 1 g, respectivamente. Em pacientes submetidos à diálise peritoneal (2 Litros/h), a cefazolina produziu
níveis séricos médios de aproximadamente 10 e 30 mcg/mL após 24 horas de instilação de uma solução de diálise contendo 50 mg/L e 150mg/L, respectivamente. Os níveis médios de Pico foram 29 mcg/ml com 50mg/L (três pacientes), 72 mcg/mL com 150 mg/L (seis pacientes). A administração intraperitoneal da cefazolina é geralmente bem tolerada. Estudos controlados em vonluntários adultos normais recebendo 1g, 4 vezes ao dia, durante 10 dias, monitorando exames hematológicos, TGO, TGP, bilirrubinas, fosfatase alcalina, uremia, creatinina e exames de urina, não demonstraram qualquer alteração clinicamente significativa que fosse atribuída à cefazolina.
- RESULTADOS DE EFICÁCIA:
Microbiologia: testes in vitro demonstraram que a ação bactericida das cefalosporinas resulta da inibição da síntese da parede celular. A cefazolina é ativa in vitro e em infecções clínicas contra os seguintes microrganismos:
Staphylococcus aureus (incluindo cepas produtoras de penicilinase);
Staphylococcus epidermidis;
Estreptococos beta-hemolíticos do Grupo A e outras cepas de estreptococos (muitas cepas de enterococos são resistentes);
Streptococcus pneumoniae;
KIebsieIIa spp.;
Escherichia coIi;
Enterobacter aerogenes;
Proteus mirabilis;
Haemophilus influenzae.
Obs.: Estafilococos meticilina-resistentes são uniformemente resistentes à cefazolina.
A maioria das cepas de Proteus indol positivos (Proteus vulgaris), Enterobacter cloacae, Morganella morganii e Providencia rettgeri é resistente. Serratia, Pseudomonas, Mima, Herellea são quase uniformemente resistentes à cefazolina.
Testes de Suscetibilidade
Técnicas de difusão: Métodos quantitativos que requerem a medição do diâmetro do halo proporcionam as estimativas mais precisas da suscetibilidade de microrganismos aos antibióticos. Um procedimento deste tipo (Ref.1) tem sido recomendado para testes de suscetibilidade à cefazolina com uso de discos.
O Teste de suscetibilidade padronizado, com um único disco (Ref.1,2) com 30 mcg de cefazolina, deve ser interpretado de acordo com os seguintes critérios:

Um resultado “suscetível” indica que o patógeno provavelmente será inibido pelos níveis sangüíneos normalmente alcançados, respondendo à terapia. Um resultado “intermediário” sugere que o microrganismo deve ser suscetível se altas doses forem usadas ou se a infecção estiver confinada nos tecidos e líquidos onde altos níveis do antibiótico são atingidos (por ex.: Urina).
Um resultado “resistente” indica que as concentrações alcançadas não serão suficientes para inibir o microorganismo e outra terapia deve ser selecionada.
Procedimentos padronizados requerem o uso de microorganismo de controle laboratorial. O disco de cefazolina 30mcg deve apresentar os seguintes halos de inibição:
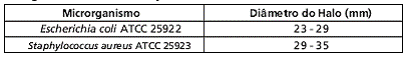
Técnicas de Diluição: Usar o método de diluição padronizado pelo Comitê Nacional de Padrões para Laboratório Clínico (caldo ou ágar) ou equivalente. Os valores de concentração inibitória mínima (CIM) obtidos devem ser interpretados de acordo com os seguintes critérios:

Um resultado “suscetível” indica que o patógeno provavelmente será inibido pelos níveis sanguíneos normalmente alcançados. Um resultado “resistente” indica que as concentrações alcançadas não serão suficientes para inibir o microrganismo e outra terapia deve ser selecionada.
Procedimentos padronizados requerem o uso de microrganismo de controle laboratorial. A cefazolina – padrão deve fornecer os seguintes valores de CIM:

Indicações de Cezolin
A cefazolina é indicada no tratamento das seguintes infecções graves causadas por microrganismos suscetíveis:
Infecções do Trato Respiratório causadas por Streptococcus pneumoniae, KIebsieIIa spp., Haemophilus influenzae, Staphylococcus aureus (penicilino-suscetíveis e penicilino resistentes), estreptococos beta-hemolíticos do grupo A. A penicilina benzatina injetável é considerada o medicamento de escolha no tratamento e prevenção de infecções estreptocócicas, incluindo a profilaxia da febre reumática.
A cefazolina é eficaz na erradicação dos estreptococos da nasofaringe; porém, até o momento não existem dados da eficácia da cefazolina na prevenção subseqüente da febre reumática.
Infecções do Trato Urinário causadas por Escherichia coli, Proteus mirabilis, KIebsieIIa spp., e algumas cepas de enterobacter e enterococos.
Infecções da Pele e Estruturas da Pele causadas por Staphylococcus aureus (penicilino-sensíveis e penicilino-resistentes), estreptococos beta-hemolíticos do grupo A e outras cepas de estreptococos.
Infecções do Trato Biliar causada por Escherichia coli, diversas cepas de estreptococos, Proteus mirabilis, Klebsiella spp. e Staphylococcus aureus.
Infecções Ósseas e Articulares causadas por Staphylococcus aureus.
Infecções Genitais (i.e., prostatite e epididimite) causadas por Escherichia coIi, Proteus mirabilis, Klebsiella spp. e algumas cepas de enterococos.
Septicemia causada por Streptococcus pneumoniae, Staphylococcus aureus (penicilino-sensíveis e penicilino-resistentes), Proteus mirabilis, Escherichia coli e Klebsiella spp.
Endocardites causadas por Staphylococcus aureus (penicilinos suscetíveis e penicilino-resistentes) e estreptococos beta-hemolíticos do grupo A. Culturas apropriadas e estudos de suscetibilidade devem ser realizados para determinar a suscetibilidade do microrganismo causador à cefazolina.
Profilaxia Cirúrgica: a administração profilática da cefazolina no pré-operatório, intra-operatório e pós-operatório pode reduzir a incidência de algumas infecções pós-operatórias em pacientes submetidos a procedimentos cirúrgicos classificados como contaminados ou potencialmente contaminados. O uso profilático da cefazolina pode também ser eficaz em pacientes cirúrgicos nos
quais uma infecção no local da cirurgia pode representar um grave risco (por exemplo durante cirurgia cardíaca a céu-aberto ou artroplastia prostética).
A administração profilática da cefazolina geralmente deve ser interrompida após um período de 24 horas após o procedimento cirúrgico. Em cirurgias onde a ocorrência de infecção pode ser particularmente devastadora (cirurgia cardíaca a céu-aberto e artroplastia prostética), a administração profilática da cefazolina pode ser continuada por 3 a 5 dias após a cirurgia.
Se houver sinais de infecção, amostras para cultura devem ser colhidas para identificação do organismo causador, de modo a instituir-se um tratamento apropriado (Veja seção POSOLOGIA).
- CONTRA-INDICAÇÕES:
A CEFAZOLINA É CONTRA-INDICADA EM PACIENTES COM ALERGIA CONHECIDA A ANTIBIÓTICOS DO GRUPO DAS CEFALOSPORINAS, PENICILINAS, DERIVADOS DA PENICILINA E PENICILAMINA.
Modo de Usar e Cuidados de Conservação de Cezolin
Atenção: medicamentos parenterais devem ser bem inspecionados visualmente antes da administração. Freqüentemente os hospitais reconstituem produtos injetáveis utilizando agulhas 40 x 12.
Pequenos fragmentos de rolha podem ser levados para dentro frasco durante o procedimento. Deve-se, portanto inspecionar cuidadosamente os produtos antes da administração, descartando- os se contiverem partículas. Agulhas 25 x 8, embora dificultem o processo de reconstituição, têm menor probabilidade de carregarem partículas de rolhas para dentro dos frascos.
Administração
CEZOLIN (cefazolina sódica) 1 g
Pode ser administrado por via intramuscular (IM) ou por via intravenosa (IV).
CEZOLIN (cefazolina sódica) 1g, por via intramuscular (IM)
Reconstituição: reconstituir com 2,5 mL de Agua Estéril para Injeção.
Pode também ser reconstituído com Solução de Lidocaína 0,5%. O produto reconstituído tem cor levemente amarelada.
Administração: injetar em grande massa muscular. Em adultos, nas nádegas (quadrante superior externo); em crianças, na face lateral da coxa.
ATENÇÃO: o produto reconstituído com Solução de Lidocaína 0,5% não pode ser administrado por via intravenosa.
Estabilidade após reconstituição: 12 horas em temperatura ambiente (15° a 30°C) ou 24 horas sob refrigeração (2° a 8°C), protegido da luz.
CEZOLIN (cefazolina sódica) 1g, por via intravenosa (IV)
IV Direta:
Reconstituição: reconstituir o conteúdo do frasco-ampola com 2,5 mL de Água Estéril para Injeção. O produto reconstituído tem cor levemente amarelada.
Diluição: diluir o produto previamente reconstituído para 10 mL de solução. Os diluentes compatíveis são: Água Estéril para Injeção, Cloreto de Sódio 09% ou Glicose 5%.
Administração: injetar direto na veia durante 3 a 5 minutos.
Estabilidade após reconstituição: 12 horas em temperatura ambiente (15° a 30°C) ou 24 horas sob refrigeração (2°a 8°C), protegido da luz.
IV Infusão:
Reconstituição: reconstituir o conteúdo do frasco-ampola com 2,5 mL de Água Estéril para Injeção. O produto reconstituído tem cor levemente amarelada.
Diluição: diluir o produto previamente reconstituído com 50 a 100 mL de Cloreto de Sódio 0,9% ou Glicose 5%.
Outras soluções compatíveis:
Glicose 10%;
Glicose 5% em Ringer Lactato;
Glicose 5% em Cloreto de Sódio 0,9%;
Glicose 5% em Cloreto de Sódio 0,45%;
Glicose 5% em Cloreto de Sódio 0,2%
Injeção de Ringer Lactato;
Açúcar Invertido 5% ou 10% em Água Estéril para Injeção;
Injeção de Ringer;
Bicarbonato de Sódio 5%.
Administração: infundir durante 30 a 60 minutos.
Estabilidade após reconstituição: 12 horas em temperatura ambiente (15° a 30°C) ou 24 horas sob refrigeração (2°a 8°C), protegido da luz.
Incompatibilidades: não se recomenda a mistura de cefazolina com outras medicações. A mistura de antibacterianos beta-lactâmicos (penicilinas e cefalosporinas) e aminoglicosídeos pode resultar em inativação de ambas substâncias. Se clinicamente necessário elas devem ser administradas por vias separadas (não misturá-las no mesmo frasco ou numa mesma bolsa intravenosa).
- POSOLOGIA:
Obs.: As doses são dadas em termos de cefazolina.
ADULTOS E ADOLESCENTES:
Infecção Urinária Aguda (não complicada): 1 g a cada 12 horas, por via intramuscular ou intravenosa.
Pneumonia Pneumocócica: 500 mg cada 12 horas, por via intramuscular ou intravenosa.
Endocardite (profilaxia): 1 g, 30 minutos antes do início da cirurgia, por infusão intravenosa.
Profilaxia Cirúrgica (via intramuscular ou intravenosa):
a. 1g, meia a uma hora antes do início da cirurgia.
b. 500 mg a 1g durante a cirurgia com duração de 2 horas ou mais.
c. 500 mg a 1g a cada 6 a 8 horas, até 24 horas após a cirurgia.
É importante que a dose pré-operatória seja administrada exatamente (meia a uma hora) antes do início da cirurgia de tal modo que níveis adequados de cefazolina estejam presentes no sangue e nos tecidos no momento da incisão cirúrgica inicial.
Em cirurgias onde a ocorrência de uma infecção pode ser particularmente devastadora (por exemplo, cirurgia cardíaca a céu-aberto ou artroplastia prostética), a administração profilática da cefazolina deve ser continuada por 3 a 5 dias após o término da cirurgia.
Outros Tipos de Infecções
Infecções leves: 250 a 500 mg, cada 8 horas, por infusão intravenosa.
Infecções moderadas a graves: 500 mg a 1 g, a cada 6 a 8 horas, por infusão intravenosa.
Infecções graves, com risco de vida (por exemplo, endocardite e septicemia): 1 a 1,5 g, cada 6 horas, por infusão intravenosa.
Limite de dose para adultos: 6 g por dia, embora em raras ocasiões doses de até 12 g por dia foram utilizadas.
Adultos com Diminuição da Função Renal
Após uma dose inicial apropriada à gravidade do caso, as doses devem ser ajustadas em função do clearance de creatinina.
Adultos com Diminuição da Função Renal

CRIANÇAS:
Endocardite (profilaxia): 25 mg por quilograma de peso corporal, 30 minutos antes do início da cirurgia, por infusão intravenosa.
Outras Infecções:
Crianças a partir de 1 mês de idade (infusão intravenosa): 6,25 a 25 mg por quilograma de peso corporal, a cada 6 horas; ou 8,3 a 33,3 mg por quilograma de peso corporal, cada 8 horas.
Crianças com menos de 1 mês de idade (infusão intravenosa): 20 mg por quilograma de peso corporal, a cada 8 ou 12 horas.
Em crianças com diminuição da função renal, após uma dose inicial apropriada à gravidade do caso, as doses devem ser ajustadas de acordo com o clearance de creatinina.
Crianças com Diminuição da Função Renal

Advertências de Cezolin
ANTES DO TRATAMENTO COM A CEFAZOLINA SER INSTITUÍDO, UM CUIDADOSO QUESTIONAMENTO DEVE SER FEITO PARA DETERMINAR SE O PACIENTE JÁ APRESENTOU REAÇÕES DE HIPERSENSIBILIDADE A OUTROS MEDICAMENTOS PARTICULARMENTE À CEFAZOLINA, OUTRAS CEFALOSPORINAS, PENICILINAS OU PENICILAMINAS. RECOMENDA-SE CUIDADO ESPECIAL AO ADMINISTRAR CEZOLIN (CEFAZOLINA SÓDICA) A PACIENTES PENICILINO-SENSÍVEIS, POIS A HIPERSENSIBILIDADE CRUZADA ENTRE ANTIBIÓTICOS BETA-LACTÀMICOS PODE OCORRER EM ATÉ 10% DOS PACIENTES COM HISTÓRIA DE ALERGIA A PENICILINA. SE UMA REAÇÃO ALÉRGICA A CEFAZOLINA OCORRER, INTERROMPA O TRATAMENTO COM O MEDICAMENTO.
REAÇÕES DE HIPERSENSIBILIDADE AGUDA GRAVES PODEM REQUERER TRATAMENTO COM EPINEFRINA (ADRENALINA) E OUTRAS MEDIDAS DE EMERGÉNCIA. INCLUINDO OXIGÉNIO, FLUIDOS I.V., ,ANTI-HISTAMÍNICOS I.V., CORTICOSTERÓIDES, AMINAS PRESSORAS E MONITORAÇÃO DAS VIAS AÉREAS, CONFORME INDICAÇÃO CLÍNICA.
FORAM RELATADOS CASOS DE COLITE PSEUDOMEMBRANOSA COM QUASE TODOS OS AGENTES ANTIBACTERIANOS INCLUINDO CEFAZOLINA. CUJA GRAVIDADE PODE VARIAR DE LEVE A RISCO DE VIDA. PORTANTO, DEVE-SE CONSIDERAR ESTE DIAGNÓSTICO EM PACIENTES QUE APRESENTEM DIARRÉIA APÓS À ADMINISTRAÇÃO DE REAGENTES ANTIBACTERIANOS.
O TRATAMENTO COM AGENTES ANTIBACTERIANOS ALTERA A FLORA NORMAL DO COLO E PODE PERMITIR O AUMENTO DE CRESCIMENTO DE CLOSTRÍDEOS. ESTUDOS INDICAM QUE A TOXINA PRODUZIDA PELO CLOSTRIDIUM DIFFICILE É UMA DAS CAUSAS PRIMÁRIAS DA “COLITE ASSOCIADA A ANTIBIÓTICOS”.
ESTABELECIDO O DIAGNÓSTICO DE COLITE PSEUDOMEMBRANOSA, MEDIDAS TERAPÊUTICAS APROPRIADAS DEVEM SER INICIADAS. OS CASOS LEVES DE COLITE PSEUDOMEMBRANOSA GERALMENTE RESPONDEM BEM APENAS À DESCONTINUAÇÃO DO TRATAMENTO. EM CASOS MODERADOS A GRAVES, DEVE-SE CONSIDERAR A NECESSIDADE DE ADMINISTRAR FLUIDOS E ELETRÓLITOS, SUPLEMENTAÇÃO PROTÉICA E TRATAMENTO COM MEDICAMENTO ANTIBACTERIANO CLINICAMENTE EFICAZ NA COLITE POR CLOSTRIDIUM DIFFICILE.
- PRECAUÇÕES:
GERAIS: O USO PROLONGADO DA CEFAZOLINA PODE RESULTAR EM CRESCIMENTO AUMENTADO DE MICRORGANISMOS NÃO SUSCETIVEIS. A OBSERVAÇÃO CLÍNICA CUIDADOSA DO PACIENTE È ESSENCIAL.
QUANDO A CEFAZOLINA É ADMINISTRADA A PACIENTES COM BAIXO DÉBITO URINÁRIO DEVIDO A DIMINUIÇÃO DA FUNÇÃO RENAL. UMA DOSE DIÁRIA MENOR É NECESSÁRIA (VER POSOLOGIA).
ASSIM COMO COM OUTROS ANTIBIÓTICOS BETA-LACTÁMICOS, CONVULSÕES PODEM OCORRER SE ALTAS DOSES FOREM ADMINISTRADAS A PACIENTES COM DIMINUIÇÃO DA FUNÇÃO RENAL (VER POSOLOGIA). A CEFAZOLINA, ASSIM COMO TODAS AS CEFALOSPORINAS, DEVE SER PRESCRITA COM CAUTELA A INDIVÍDUOS COM HISTÓRIA DE DOENÇA GASTROINTESTINAL, PARTICULARMENTE COLITE.
A ADMINISTRAÇÃO INTRATECAL DE CEFAZOLINA NÃO ESTÁ APROVADA; HOUVE RELATOS DE TOXICIDADE GRAVE DO SISTEMA NERVOSO CENTRAL, INCLUINDO CONVULSÕES, QUANDO A CEFAZOLINA FOI ADMINISTRADA POR ESTA VIA.
CARCINOGÉNESE. MUTAGÉNESE: NÃO FORAM REALIZADOS ESTUDOS MUTAGÊNICOS E DE LONGO PRAZO EM ANIMAIS PARA AVALIAR O POTENCIAL CARCINOGÉNICO DA CEFAZOLINA.
USO NA GRAVIDEZ: CATEGORIA DE RISCO B, SEGUNDO CLASSIFICAÇÃO DO FDA AMERICANO. ESTUDOS DE REPRODUÇÃO FORAM REALIZADOS EM CAMUNDONGOS, RATOS E COELHOS, COM DOSES ATÉ 25 VEZES SUPERIORES A DOSE HUMANA HABITUAL. E NÃO REVELARAM NENHUMA EVIDÊNCIA DE PREJUÍZO SOBRE A FERTILIDADE OU DANO AO FETO CAUSADO POR CEFAZOLINA.
ENTRETANTO, NÃO HÁ ESTUDOS BEM CONTROLADOS EM MULHERES GRÁVIDAS. COMO OS ESTUDOS DE REPRODUÇÃO EM ANIMAIS NEM SEMPRE SÃO PREDITIVOS DA RESPOSTA HUMANA, ESTE MEDICAMENTO NÃO DEVE SER UTILIZADO POR MULHERES GRÁVIDAS SEM ORIENTAÇÃO MÉDICA OU DO CIRURGIÃO DENTISTA A NÃO SER QUE SEJA EVIDENTEMENTE NECESSÁRIO.
TRABALHO DE PARTO: QUANDO A CEFAZOLINA FOI ADMINISTRADA ANTES DA CIRURGIA CESARIANA, OS NÍVEIS DO MEDICAMENTO NO SANGUE DO CORDÃO UMBILICAL FORAM
APROXIMADAMENTE UM QUARTO A UM TERÇO DOS NIVEIS DO MEDICAMENTO NA MÃE. A DROGA PARECE NÃO TER NENHUM EFEITO ADVERSO NO FETO.
USO NA AMAMENTAÇÃO: A CEFAZOLINA ESTÁ PRESENTE EM NÍVEIS MUITO BAIXOS NO LEITE MATERNO. NÃO FORAM, CONTUDO DOCUMENTADOS PROBLEMAS.
USO EM IDOSOS, CRIANÇAS E OUTROS GRUPOS DE RISCO: PACIENTES IDOSOS PODEM EXIGIR AJUSTE DAS DOSES SE HOUVER DIMINUIÇÃO DA FUNÇÃO RENAL. A SEGURANÇA E A EFICÁCIA EM PREMATUROS AINDA NÃO FORAM ESTABELECIDAS. VER SEÇÃO POSOLOGIA A DOSE RECOMENDADA A PACIENTES COM MAIS DE UM MÊS DE IDADE.
Interações Medicamentosas de Cezolin
UM AUMENTO NA INCIDÊNCIA DE NEFROTOXICIDADE FOI RELATADO APÓS ADMINISTRAÇÃO CONCOMITANTE DE ANTIBIÓTICOS CEFALOSPORÍNICOS E AMINOGLICOSÍDEOS. NÃO SE RECOMENDA A MISTURA DE CEFAZOLINA COM OUTRAS MEDICAÇÕES. A MISTURA DE ANTIBACTERIANOS BETALACTÁMICOS (PENICILINAS E CEFALOSPORINAS) E AMINOGLICOSÍDEOS PODE RESULTAR EM INATIVAÇÃO DE AMBAS SUBSTÂNCIAS. SE CLINICAMENTE NECESSÁRIO ELAS DEVEM SER ADMINISTRADAS EM LOCAIS SEPARADOS (NÃO MISTURÁ-LAS NO MESMO FRASCO OU NUMA MESMA BOLSA INTRAVENOSA).
A PROBENECIDA AUMENTA AS CONCENTRAÇÕES PLASMÁTICAS DE CEFAZOLINA E PODE AUMENTAR OS RISCOS DE TOXICIDADE.
Interações com Testes de Laboratório de Cezolin
REAÇÕES PARA GLICOSE NA URINA FALSO POSITIVAS PODEM OCORRER COM SOLUÇÃO DE BENEDICT OU SOLUÇÃO DE FEHLING, MAS NÃO COM TESTES ENZIMÁTICOS. TESTES DE ANTIGLOBULINA (COOMBS) DIRETOS E INDIRETOS POSITIVOS OCORRERAM; ESTE FATO TAMBÉM PODE OCORRER EM NEONATOS CUJAS MÃES RECEBERAM CEFALOSPORINAS ANTES DO PARTO.
Reações Adversas de Cezolin
AS SEGUINTES REAÇÕES ADVERSAS FORAM RELATADAS:
GASTROINTESTINAIS: DIARRÉIA, CANDIDÍASE ORAL (SAPINHO), VÔMITOS, NÁUSEAS, CÓLICAS DE ESTÔMAGO, ANOREXIA E COLITE PSEUDOMEMBRANOSA. O INÍCIO DOS SINTOMAS DA COLITE PSEUDOMEMBRANOSA PODE OCORRER DURANTE OU APÓS O TRATAMENTO COM ANTIBIÓTICOS (VER ADVERTÊNCIAS).
NÁUSEAS E VÔMITOS FORAM RELATADOS RARAMENTE.
ALÉRGICAS: ANAFILAXIA, EOSINOFILIA, COCEIRA, FEBRE À DROGA, ERUPÇÕES CUTÂNEAS E SÍNDROME DE STEVENS-JOHNSON.
HEMATOLÓGICAS: NEUTROPENIA, LEUCOPENIA, TROMBOCITOPENIA E TROMBOCITEMIA. HEPÁTICAS E RENAIS: ELEVAÇÃO TRANSITÓRIA DE TGO, TGP, UREMIA E FOSFATASE ALCALINA FORAM OBSERVADAS SEM EVIDÊNCIA CLÍNICA DE PREJUÍZO RENAL OU HEPÁTICO.
REAÇÕES LOCAIS: RAROS CASOS DE FLEBITE NO LOCAL DA INJEÇÃO FORAM RELATADOS. DOR NO LOCAL DA INJEÇÃO APÓS ADMINISTRAÇÃO INTRAMUSCULAR FOI RELATADA COM BAIXA FREQUÊNCIA. HOUVE OCORRÊNCIA DE ALGUNS CASOS DE ENDURAÇÃO.
OUTRAS REAÇÕES: PRURIDO GENITAL E ANAL (INCLUINDO PRURIDO VULVAR, MONILÍASE GENITAL E VAGINITE).
- SUPERDOSAGEM:
EM CASOS DE SUPERDOSAGEM PROCURAR POR UM CENTRO DE CONTROLE DE INTOXICAÇÕES OU UM HOSPITAL.
SINAIS E SINTOMAS: OS SINAIS E SINTOMAS TÓXICOS APÓS UMA SUPERDOSE DE CEFAZOLINA PODEM INCLUIR DOR, INFLAMAÇÃO E FLEBITE NO LOCAL DA INJEÇÃO.
A ADMINISTRAÇÃO DE GRANDES DOSES INADEQUADAS DE CEFALOSPORINAS PARENTERAIS PODE CAUSAR TONTURA, PARESTESIA E CEFALÉIA. APÓS UMA SUPERDOSE PODE OCORRER CONVULSÕES COM ALGUMAS CEFALOSPORINAS, PARTICULARMENTE EM PACIENTES COM INSUFICIÊNCIA RENAL, NOS QUAIS PODE OCORRER ACÚMULO.
AS ANORMALIDADES NOS VALORES DE LABORATÓRIO QUE PODEM OCORRER, APÓS UMA SUPERDOSE, INCLUEM ELEVAÇÕES NA CREATININA, NITROGÊNIO URÉICO SANGUÍNEO (BUN), ENZIMAS HEPÁTICAS E BILIRRUBINA. TESTE DE COOMBS POSITIVO, TROMBOCITOSE, TROMBOCITOPENIA, EOSINOFILIA, LEUCOPENIA E AUMENTO DO TEMPO DE PROTROMBINA.
TRATAMENTO: AO TRATAR UMA SUPERDOSAGEM, CONSIDERAR A POSSIBILIDADE DE SUPERDOSAGEM DE MÚLTIPLAS DROGAS, INTERAÇÃO ENTRE DROGAS E DE CINÉTICA INUSITADA DA DROGA NO PACIENTE.
SE OCORREREM CONVULSÕES, A DROGA DEVE SER SUSPENSA IMEDIATAMENTE E UMA TERAPIA ANTICONVULSIVANTE DEVE SER ADMINISTRADA. SE CLINICAMENTE INDICADO. PROTEGER A PASSAGEM DE AR PARA O PACIENTE E MANTER VENTILAÇÃO E PERFUSÃO. MONITORAR E MANTER METICULOSAMENTE DENTRO DE LIMITES ACEITÁVEIS OS SINAIS VITAIS DO PACIENTE, OS GASES DO SANGUE, ELETRÓLITOS SÉRICOS, ETC. EM CASOS DE SUPERDOSAGEM GRAVE, ESPECIALMENTE EM PACIENTES COM INSUFICIÉNCIA RENAL, DEVE SER CONSIDERADA A HEMODIÁLISE E HEMOPERFUSÃO COMBINADA. SE FALHAR A RESPOSTA COM OUTRAS TERAPIAS. CONTUDO, NÃO HÁ DADOS DISPONÍVEIS SOBRE ESTA TERAPIA.
- ARMAZENAGEM:
Conservar o produto em sua embalagem original à temperatura ambiente (entre 15° a 30°C). Proteger da luz.
Referências Bibliográficas de Cezolin
1. Bauer, A.W.: Kirby, W.M.M.; Sherris, J.C., and Turck, M.: Antibiotic Testing by a Standadized Single Disc Method,
2. Am. J. Clin. Path. 45:493, 1966. Standadized Disc Susceptibility Test. Federal Register 39: 19182-19184, 1974.
3. Handbook on Injectable Drugs, 12 th Edition, 2003, Lawrence A. Trissel, American Society of Health-System Pharmacists R.
4. Physicians’ Desk Reference, 53 Edition, 2000, Thomson PDR at Montvale, NJ 07645-1742.
5. Drug information for the Health Care Professional – USP DI, 24 Edition, 2004, Thomson – Micromedex.
VENDA SOB PRESCRIÇÃO MÉDICA
TODO MEDICAMENTO DEVE SER MANTIDO FORA DO ALCANCE DAS CRIANÇAS.
Número do lote, data de fabricação e data de validade: vide cartucho.
Fabricado por: INSTITUTO BIOCHIMICO IND. FARM. LIMITADA
Endereço: Rua Antônio João, n°218 – Cordovil – Rio de Janeiro – RJ
CNPJ: 33.258.401/0001-03
Reg. MS 1.0063.0177
Farm. Resp.: Andrea P.Weber. CRF-RJ n° 5952
Indústria Brasileira

